第一篇新冠单细胞文献!|解读
前言
NGS系列文章包括NGS基础、转录组分析 (Nature重磅综述|关于RNA-seq你想知道的全在这)、ChIP-seq分析 (ChIP-seq基本分析流程)、单细胞测序分析 (重磅综述:三万字长文读懂单细胞RNA测序分析的最佳实践教程 (原理、代码和评述))、DNA甲基化分析、重测序分析、GEO数据挖掘(典型医学设计实验GEO数据分析 (step-by-step) - Limma差异分析、火山图、功能富集)等内容。
我们之前也发表过有关新冠病毒受体ACE2组织分布的解读,基本上是利用公共数据库对其分布及特异性进行分析,而这篇文章是研究团队利用新冠病毒感染进行的单细胞转录组分析,是第一篇报道新冠肺部免疫微环境的单细胞文献。这开启了单细胞分析在新冠方面的应用。
2020年2月23日,深圳第三人民医院在medRixv预印本上发表题为The landscape of lung bronchoalveolar immune cells in COVID-19 revealed by single-cell RNA sequencing的研究内容,对患者肺泡灌洗液(Balf)进行转录组分析及TCR分析,比较分析了重症患者和轻症患者的肺部免疫微环境。



可上下滑动
研究背景
(1)尚不完全清楚为什么有些患者会因相同的SARS-CoV-2感染而发展为重症,而其他患者却患有轻度甚至无症状;
(2)Human Coronaviruses(hCoVs)引起的呼吸窘迫综合征的免疫发病机制可能涉及干扰素产生紊乱、炎症反应过度和细胞因子风暴、中和抗体诱导无效或延迟以及特异性T细胞反应;
研究方案
sample:6名COVID-19患者的肺支气管肺泡灌洗液(BALF)细胞,包括3例重症和3例轻度病例。分别进行单细胞RNA测序(scRNA-seq)和单细胞TCR-seq。
测序数据分析介绍:
工具:
Chromium Single Cell 5′ Library and Gel Bead Kit(10X Genomics);
比对: GRCh38;
筛选:
Following criteria were then applied to each cell, i.e., gene number between 200 and 6000, UMI count above 1000 and mitochondrial gene percentage below 0.1;
降维聚类:
Seurat v3标准流程,PCs=50,使用UMAP进行展示;
轨迹分析:
Slingshot;
调控网络:
SCENIC;
TCR V(D)J测序分析:
通过Cell Ranger V(D)J(v3.1.0)组装单个T细胞的TCR序列,鉴定CDR3序列和重新排列的TCR基因。
结果分析
COVID-19患者肺部免疫微环境解析
为了识别新冠感染后肺部的免疫微环境,作者对3例恢复期的轻症和3例重症患者BALF进行10X单细胞转录组测序,共收集到37820个细胞。患者的临床指征如table1所示。
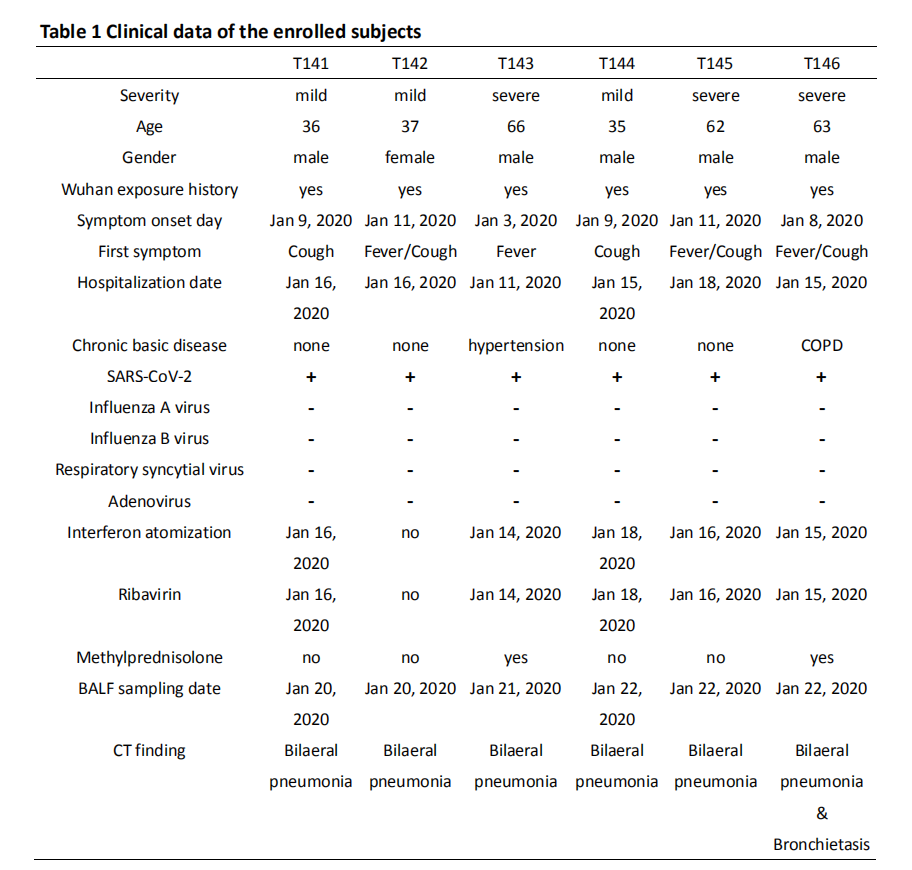
table1
作者使用公共数据(8个正常人的肺组织)作为对照。在聚类分析中共发现36个细胞亚群,包括巨噬细胞、NK&T、B和浆细胞、上皮和内皮细胞。通过以下marker鉴得细胞类型:巨噬细胞(CD68),T&NK(CD3D,KLRF1),B和浆细胞(MS4A1),上皮细胞(AGER,SFTPC,SCGB3A2,TPP3,KRT5),内皮细胞(VWF)和成纤维细胞(DCN)(图1)。与此同时,作者在重症新冠患者的BLAF中发现了低载量的病毒转录组,而在轻症和healthy control(HC)组中未发现这一现象,作者认为这是细胞破裂释放的污染所致。
然后作者对不同样本的细胞比例进行分析(图1f)。研究人员发现与健康对照相比,COVID-19感染的患者存在更高比例的T和NK细胞以及较低比例的上皮细胞。与轻症患者相比,重症患者含有更高比例的巨噬细胞,较低比例的T和NK(图1E和F)。总而言之,该数据显示了免疫细胞在面对COVID-19时会发生免疫细胞的招募增加,并且轻重症患者的免疫细胞比例有所区别。
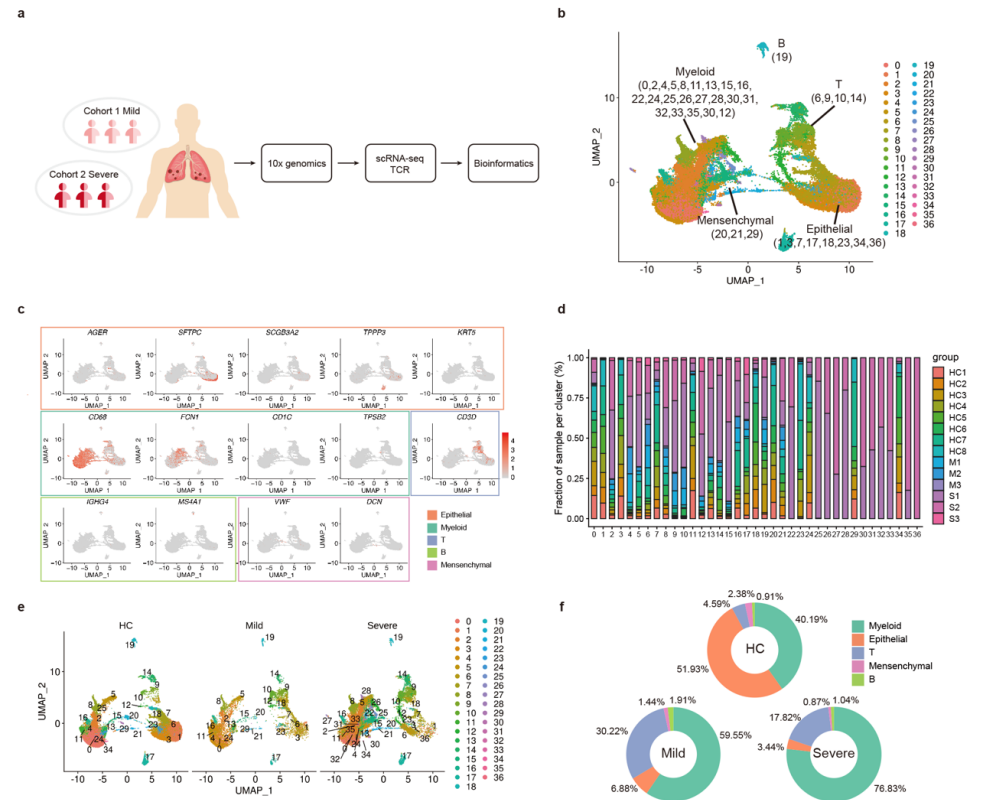
图1. Single cell atlas of BALFs from SARS-CoV-2-infected lungs and controlled lung tissues. HC1-HC8: healthy controls, M1-M3: mild cases, S1-S3: severe cases.

可上下滑动
重症新冠患者肺内巨噬细胞组成失调
在前期已经发现了肺内巨噬细胞比例有所增加,因此为了探究巨噬细胞的异质性,单独对巨噬细胞进行重新聚类,自动聚类为22个clusters(C1-C22)。除C15为DC细胞外,其余分别为Group 1(C9、C10,简称FCNhi),Group2(C0、C6、C12、C16、C19,简称FCNlowSPP1+),Group3(C7、C8,简称FCN-SPP1+),Group4(C1-C5、C11、C13、C14、C17、C20、C21、C22,简称FABP4+),如图2所示;
作者发现重症患者的巨噬细胞组成与轻症和健康人存在区别较大 (图2C) ,并且这种区别在FCN1、SPP1和FABP4的表达水平上也有体现。对照组和轻度COVID-19患者高表达FCN1,而重度COVID-19患者高表达SPP1和FABP4(图2E)(注意:这里应该是作者笔误,图中表现为对照和轻度高表达是FABP4,重度高表达的是FCN1和SPP1)。这些数据表明,在重症COVID-19患者中,肺巨噬细胞群体的平衡失调,表现为Group1 单核细胞衍生巨噬细胞(FCN1+)、Group2和3 巨噬细胞(SPP1+)显着增加,而Group 2 肺AM(FABP4+)几乎完全丧失。
为了进一步了解上述4组巨噬细胞的差异,作者进行了基因表达(GEX)分析(图2F)。Group1表达与炎性单核细胞相关的基因S100A8、S100A9、VCAN、FCN1、CD14、SELL。Group2表达趋化因子CCL2、CCL3、CCL4、CXCL9、CXCL10、CXCL11和ISG APOBEC3A、ISG15、ISG20、GBP1、ITITM3、MX1等。Group3表达免疫调节基因A2M、GPR183、CCL13等以及促纤维化基因TREM2、TGFB1、SPP1。Group4表达典型的AM基因,例如FABP4、FABP5、INHBA、MACRO、TFRC、MRC1等。
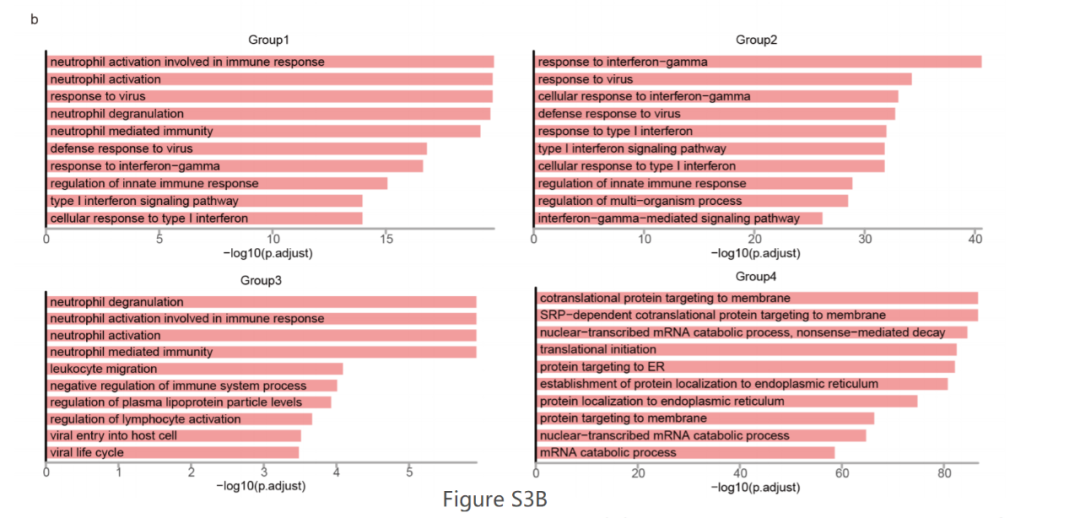
进一步的GSEA和GO富集分析显示Group1、2和3组更加活化和炎性功能,而Group4具有脂质代谢功能(图2G和图S3B)。使用SCENIC,作者推测了巨噬细胞组中的转录因子(TFs)活性(图2H)。作者发现Group1、2和3组巨噬细胞中的STAT1,STAT2和多种IFN调节因子(IRF)活性增强,这与它们的炎症表型和功能一致。作者还鉴定了M2样的TF,Group3巨噬细胞中的MAF和CREB1,以及AM-TF,Group4巨噬细胞中的PPARG和BHLHE41。最后,作者还分析了巨噬细胞亚群的分化轨迹并发现了一条线性路径:从Group1开始,然后是Group2和3,最后是Group4(图2I)。
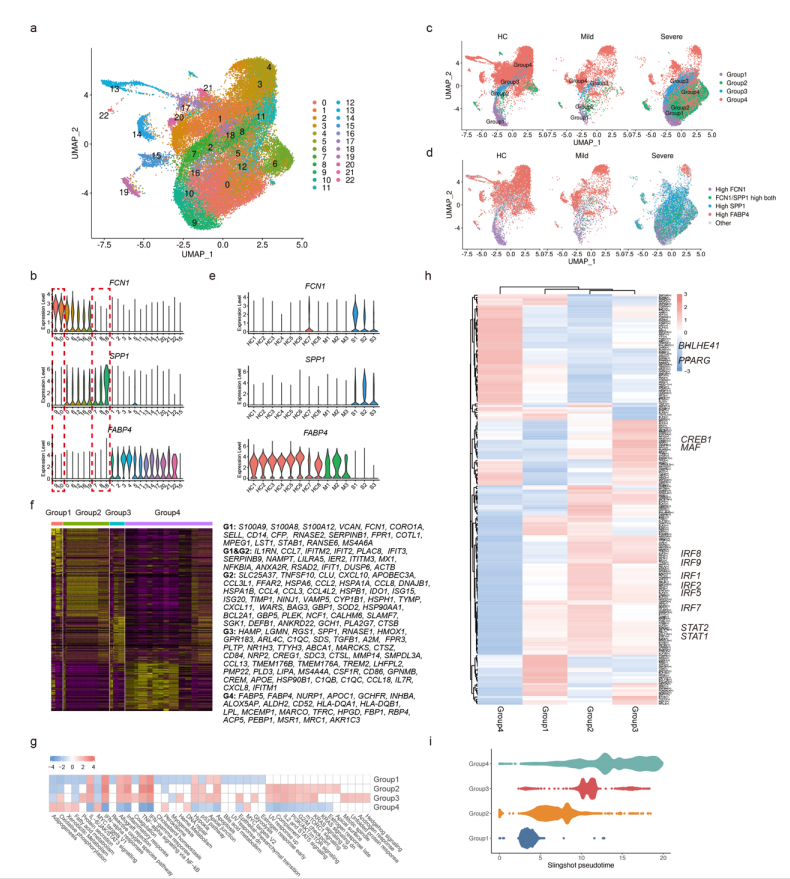
图2. Perturbed CD68+ macrophage compartments in severe COVID-19


可上下滑动
COVID-19患者肺部BALF中T细胞和NK细胞反应的特征
NK和T淋巴细胞是针对病毒感染的免疫效应细胞。已有研究表明(Zheng J et al.)[1],强烈的早期T细胞反应在急性呼吸道感染期间在病毒清除中起关键作用。对T和NK细胞重新聚类分群分为5个亚群 (图3A和3B) ,其中NK细胞高表达KLRF1、KLRC1和KLRD1。CD8+ T细胞高表达CD8A和CD8B,CD4+T细胞(CCR7+)高表达CD4和IL7R,Treg细胞表达CTLA4+FOXP3+IL2RA+,增殖细胞表达TYMS+MKI67。
与对照组相比,新冠患者中的NK和T细胞比例明显增高 (图1F和3C)。与轻症患者相比,重症患者中CD8+ T细胞比例较低,增殖细胞比例较高 (图3C和3D) 。GEX分析显示CD8+ T细胞高表达效应分子的基因,如GZMA、GZMK、FASLG、CCL5等,并且表达固有T细胞markers,ITGA1、CXCR6、JAML等,表明其似乎在免疫防御中起重要作用。
轻度患者中肺CD8+ T细胞数量的增加可能表明CD8+ T细胞在清除病毒中的作用,而重症患者中较高水平的T细胞增殖则值得探究。作者认为这可能与过度炎症引起的旁观者激活或严重COVID-19中感染的延迟反应有关。为了进一步了解轻度和重度患者之间每个NK和T细胞亚群的相关功能状态,研究人员进行了GEX分析。发现轻度病例CD8+ T细胞中T细胞的活化、迁移、钙离子信号分子相关基因被上调,而重症患者CD8+ T细胞中的病毒反应、代谢产物和能量生成以及翻译起始分子相关基因被上调(图3E和3F)。因此,这些数据证实了假设,即轻症患者中CD8+ T细胞更有助于清除病毒,而重度患者中的CD8+ T细胞正在准备增殖。
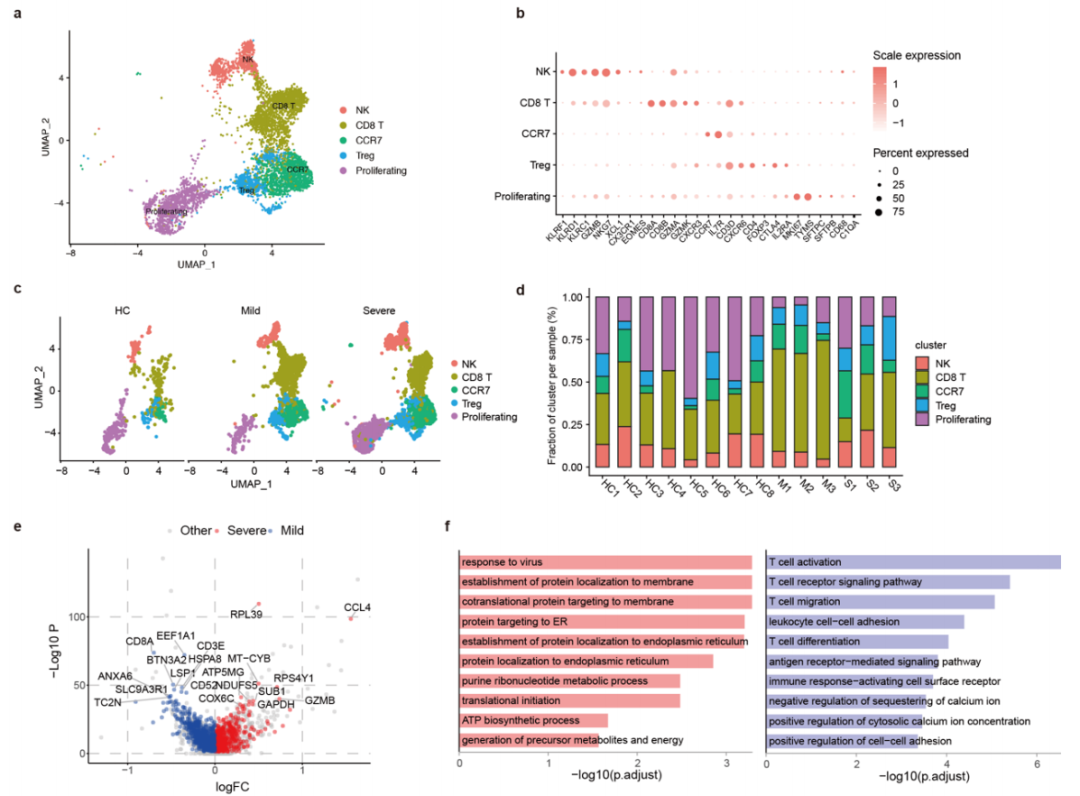
图3. Analysis of the BALF T and NK lymphocytes in COVID-19 patients

可上下滑动
COVID-19患者的BALF中单细胞TCR免疫组库的特征
当遭遇抗原时,特定的B和T淋巴细胞通过克隆扩增产生反应,从而产生具有相同特异性的效应细胞和记忆细胞,以应对入侵的病原体。扩增的抗病毒T细胞克隆可能在病毒感染期间根据不同情况发挥保护或致病功能。
作者利用单细胞TCR-seq来评估患者BALF中克隆扩增的状态。不出所料,CCR7+ T细胞作为幼稚或中央记忆细胞,几乎没有克隆扩增,而CD8+效应T细胞在不同T细胞亚群中显示出最高的扩增水平(图4A)。增殖T细胞和Treg细胞也显示出一定程度的扩增,但程度较低。
接下来,作者检查了COVID-19轻症和重症患者之间克隆扩增的比例,发现轻度疾病组的总T细胞和CD8+ T细胞的扩增水平均显着高于重症患者(图4B和4C)。平均而言,轻症组中超过50%的CD8+ T细胞是扩增的克隆,可能代表SARS CoV-2特异性T细胞,还显示出比重症患者更高的扩增指数(图4C)。在个体水平上,作者还发现与3名重症患者相比,3名轻度患者始终保持较高的T细胞克隆性(图4D),这表明高度扩增的CD8+ T细胞参与了SARS-CoV-2感染的清除。为了确认扩增的T细胞克隆的功能状态,研究团队在扩增的CD8+ T细胞与未扩增的细胞之间进行了GEX分析,发现信号和组织固有基因(包括XCL1、XCL2、ZNF683、HOPX、CXCR6和ITGAE等)的表达增加。这进一步支持了那些扩增的CD8+ T细胞的效应分子功能(图4E)。
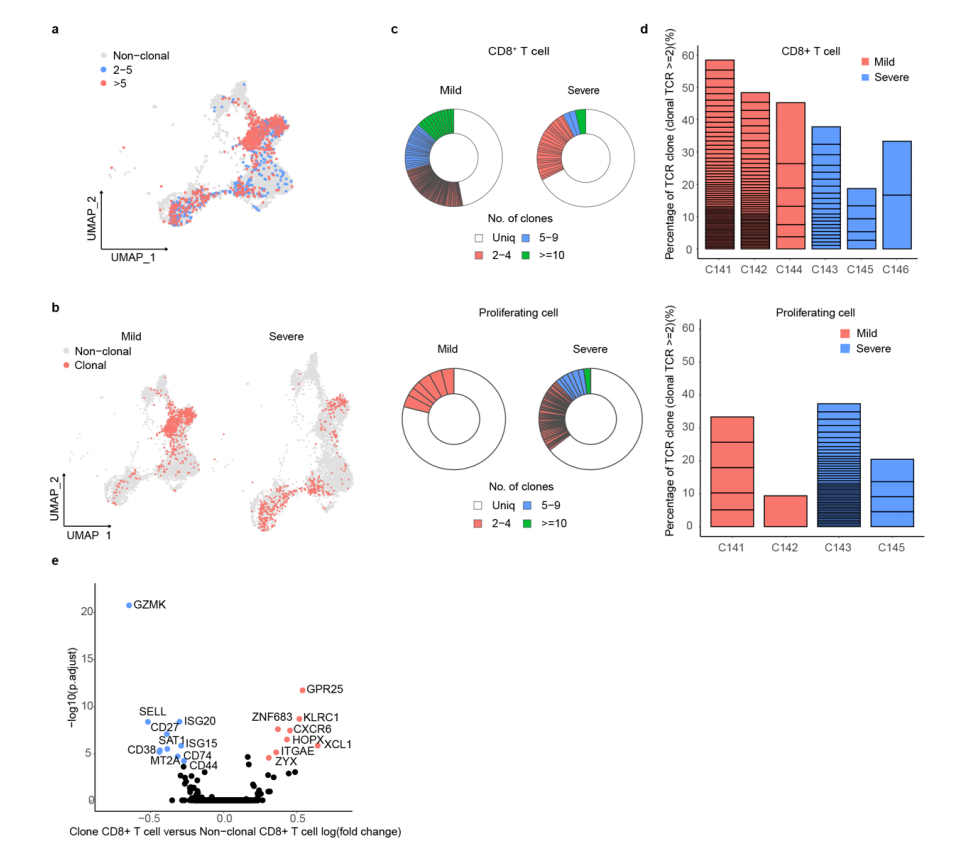
图4. Analysis of the T cell clonal expansion in BALF of SARS-COV-2 infected patients

可上下滑动

感觉本文章和大多数单细胞文献一样,侧重于描述分析,概括起来主要观点有以下几个:
(1)与健康对照相比,COVID-19感染的患者存在更高比例的T和NK细胞,较低比例的上皮细胞。与轻症患者相比,重症患者含有更高的巨噬细胞比例,较低比例的T和NK细胞;
(2)在重症COVID-19患者中,肺巨噬细胞群体的平衡失调,表现为Group1 单核细胞衍生巨噬细胞(FCN1 +)、Group2和3 巨噬细胞(SPP1 +)显着增加,而Group 2 lung AM(FABP4+)几乎完全消失;
(3)与健康对照组相比,新冠患者中NK和T细胞比例明显增高 (图1F和3C)。与轻症患者相比,重症患者CD8+T细胞比例较低,增殖细胞比例较高 ;
(4)轻度疾病组的总T细胞和CD8+ T细胞的扩增水平均显着高于重症患者,表明克隆扩增的CD8+ T细胞的高效的效应分子水平;
[1]:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5835172/
文章解读:Tiger
文章校对:生信宝典
你可能还想看
往期精品(点击图片直达文字对应教程)
后台回复“生信宝典福利第一波”或点击阅读原文获取教程合集