蛋白质生物学概述(一)
生物分子的强、弱相互作用及种类
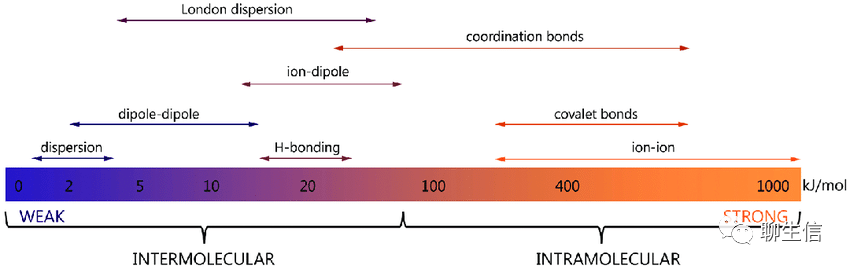
从生物分子内到分子间、从强到弱的作用力依次为:离子键(ion-ion)、共价键(covalent bonds)、配位键/配价键(coordination bonds);离子偶极(ion-dipole)、london dispersion(伦敦色散)、氢键(H-bonding)、偶极偶极力(dipole-dipole)、色散力(dispersion)。如下图:
DOI:10.1002/advs.201900506
https://www.slideserve.com/medea/properties-of-water
部分与蛋白质有关的作用力:
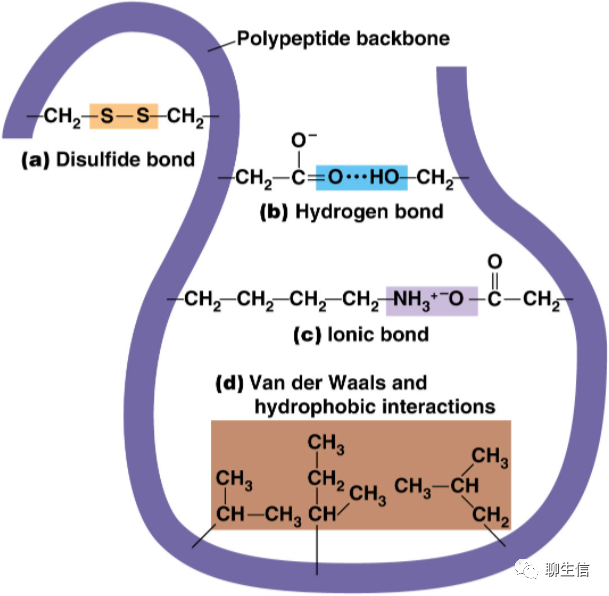
离子键(ion-ion):也称为盐键,由两个或多个原子或化学基团失去或获得电子而成为离子后形成,即带负电和带正电的原子或基团之间产生的静电吸引力。
共价键(covalent bonds):两个或多个 原子 共同使用它们的外层电子,在理想情况下达到电子饱和的状态,由此组成比较稳定的化学结构。其本质是 原子轨道重叠后,高概率地出现在两个原子核之间的电子与两个原子核之间的电性作用。
配位键/配价键(coordination bonds):常以一个由给电子的原子指向受电子的原子的箭头表示之。例如存在于配位化合物分子中的配价键。
离子偶极(ion-dipole)和偶极偶极力(dipole-dipole):分子-分子,或分子-离子之间的作用力(定向力、诱导力、色散力),以及由此而产生的没有方向性和饱和性的作用力,也叫非专属作用力,包括:离子偶极力,偶极偶极力、偶极诱导偶极力,瞬时偶极诱导偶极力。常用极性来概括表示这些作用力,属于分子间力(广义)。库仑力即静电吸引力,它包括离子离子力和离子偶极力。电荷分布不对称的电中性分子具有永久偶极矩μ。对于这种偶极分子,如果用q表示电量相等的两个相反电荷,而用d表示它们分开的距离,则偶极矩μ=qd。当将这种偶极置于某种离子所产生的电场中时,偶极本身会发生定向,吸引端(此端的电荷与离子电荷相反)将向着离子,而排斥端将背着离子。
伦敦色散力 (London Dispersion Force)和色散力(dispersion):是范德华作用力(Van Der Waal Force)的一种,广泛存在于所有分子之间。这起因于分子内电子和原子核的不断运动(分子的变形性),产生分子的瞬间偶极矩 ,并在邻近分子中诱导一个偶极矩,它们之间的相互作用产生净吸引力。
氢键(Hydrogen Bond):氢原子与电负性大的原子X以共价键结合,若与电负性大、半径小的原子Y(O、F、N等)接近,在X与Y之间以氢为媒介,生成X-H…Y形式的一种特殊的分子间或分子内相互作用。X与Y可以是同一种类分子,如水分子之间的氢键;也可以是不同种类分子,如一水合氨分子(NH3·H2O)之间的氢键。
疏水作用(hydrophobic interaction):疏水作用力,不属于化学键,而是多肽链上的某些氨基酸的疏水基团或疏水侧链(非极性侧链),由于避开水而造成相互接近、粘附聚集在一起,在维持蛋白质三级结构方面占有突出地位。
下文关于蛋白质生物学的内容主要来自《Molecular Biology of the Cell》的第四版 ("Protein Function"章节)。
我们已经知道,每种类型的蛋白质都由一个精确或确定的氨基酸序列组成,使其能够折叠成特定的三维形状或构象,拥有设计精良的运动部件(moving parts),且可将机械动作(mechanical actions)与化学事件相耦合。这些特性赋予了蛋白质非凡的能力,成为活细胞动态(生物)过程的基础。
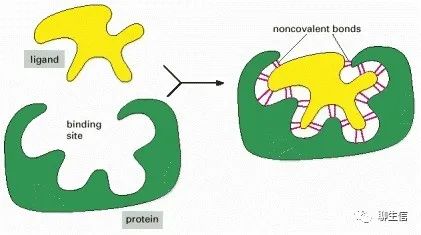
所有的蛋白都能与其它分子结合
因此,“binding”是蛋白质的第一大特性。被结合的无论是离子、小分子还是大分子,都被称为该蛋白质的配体(来源于拉丁语ligare,意思是“to bind”)。
蛋白质选择性结合并与配体具有高亲和力的能力取决于:一组弱的、非共价键,例如氢键、离子键和范德华力,以及有利的疏水相互作用的形成。因为每个单键都是弱键,有效的结合作用需要同时形成许多弱键。
只有当配体分子的表面轮廓与蛋白质非常接近,就像手套里的手一样匹配,这才有可能实现,这是蛋白质与第二分子(配体)结合的一个原则,促使蛋白质和配体之间形成大量的非共价键。
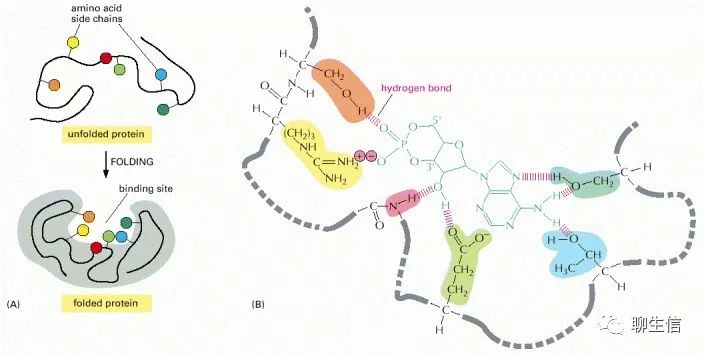
(A)多肽链的折叠通常会在蛋白质表面产生缝隙或空腔。这个缝隙中含有一组氨基酸侧链,它们只能与某些配体形成非共价键。(B)一个实际结合位点的特写,显示了蛋白质和它的配体之间形成的氢键和离子相互作用,在这个例子中cAMP(cyclic AMP)是结合的配体。
虽然隐藏在蛋白质内部的原子与配体没有直接接触,但它们提供了一个基本的支架,使蛋白质表面具有特定轮廓和化学性质。即使是蛋白质分子内部氨基酸的微小变化也能改变其三维形状,足以破坏其表面的结合位点。
蛋白质构象的细节决定了它的化学性质
蛋白表面相邻的化学基团通常以增强氨基酸侧链的化学反应性的方式进行相互作用:
排除水分子。水分子之间倾向于形成氢键,也可以与配体竞争蛋白质表面的位置,如果排除水分子,蛋白质及其配体之间的氢键(和离子间的相互作用)的紧密性将大大增加;
相邻、相同极性氨基酸在侧链的聚集。如果一些带负电荷的侧链通过蛋白质折叠的方式,在相互排斥的情况下被迫聚集在一起,那么它们对一个带正电荷的离子的位点亲和力就会大大增加。此外,当氨基酸侧链通过氢键相互作用时,通常不反应的侧基(如下图中丝氨酸上的CH2OH)可以发生反应,使它们能够进入“产生或破坏其它分子共价键”的反应。
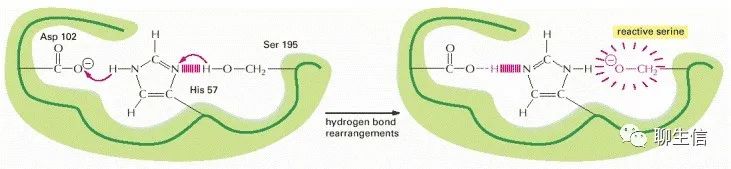
因此,每个蛋白质分子的表面都具有独特的化学反应性,这不仅取决于哪些氨基酸侧链暴露在外,还取决于它们彼此之间的确切方向。因此,即使是同一蛋白质分子的两种稍有不同的构象,其化学性质也可能有很大的不同。
蛋白家族内的序列比较可发现配体结合的关键位点
因此,可以利用进化追踪(“evolutionary tracing”)的方法来确定蛋白质结构域中对结构域功能最重要的部位。为此,可将所有已知蛋白质家族成员中未改变或几乎未改变的氨基酸映射到某个家族成员的三维结构模型上,最固定(invariant)(可能最重要)的位置通常会在蛋白质表面形成一个或多个簇,如下图。这些簇通常是与配体结合的关键位点。
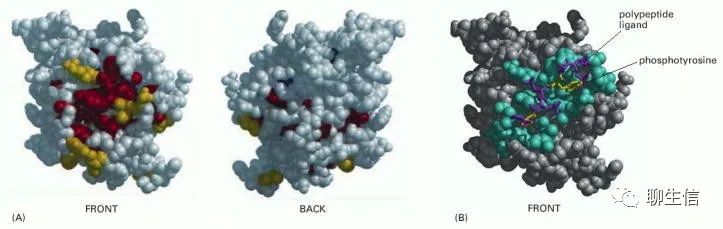
(A) SH2结构域空间填充模型的正面和背面视图,蛋白质表面进化保守的氨基酸为黄色,更靠近蛋白质内部的氨基酸为红色。(B) SH2结构域及其结合多肽的结构。在这里,那些位于结合配体0.4 nm范围内的氨基酸显示为蓝色。配体的两个关键氨基酸是黄色的,其他的是紫色的。
蛋白与蛋白互作时的几种接口类型
两种蛋白质相互结合的三种方式:
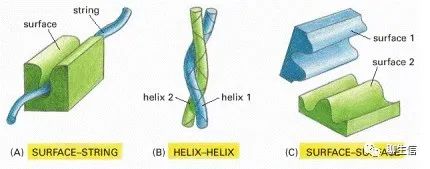
(A)一种蛋白质的刚性表面(rigid surface)可以与第二种蛋白质的多肽链的延伸环(a “string”:extended loop of polypeptide chain)结合。(B)两个α螺旋可以结合在一起形成一个线圈。(C)两个互补的刚性表面(Surface-Surface)经常将两个蛋白质结合在一起。
1. 表面-串(surface–string interaction)相互作用。一个蛋白质表面的一部分与另一个蛋白质上的多肽链的延伸环相接触。例如这种表面-串的相互作用,使SH2结构域能够识别磷酸化的多肽,就像刚才描述的那样,它也使蛋白激酶能够识别它将要磷酸化的蛋白质。具有定位、识别与引导等功能。
2. 两个α螺旋形成卷曲螺旋(coiled-coil),存在于一些基因调节蛋白家族中。
3. 通过一个刚性表面与另一个刚性表面的精确匹配,是蛋白质相互作用最常见的方式。这种相互作用可能非常紧密,因为在两个匹配良好的表面之间会形成大量的弱键。出于同样的原因,这种表面-表面的相互作用可以是非常特异的,使蛋白质可以从细胞中发现的数千种不同的蛋白质中,准确选择一个伙伴或伴侣。
抗体的结合位点尤其多变
抗体或免疫球蛋白是免疫系统对外来分子(如入侵微生物表面的分子)作出反应而产生的蛋白质。每个抗体都与特定的目标分子紧密结合,因此要么直接使目标失活,要么将其标记为(可以)摧毁。抗体以显著的特异性识别它的靶靶标(抗原)。因为我们可能会遇到数十亿种不同的抗原,所以我们必须能够产生数十亿种不同的抗体(聊生信:但我们并不需要拥有数十亿种基因,这正是免疫学迷人的地方之一)。
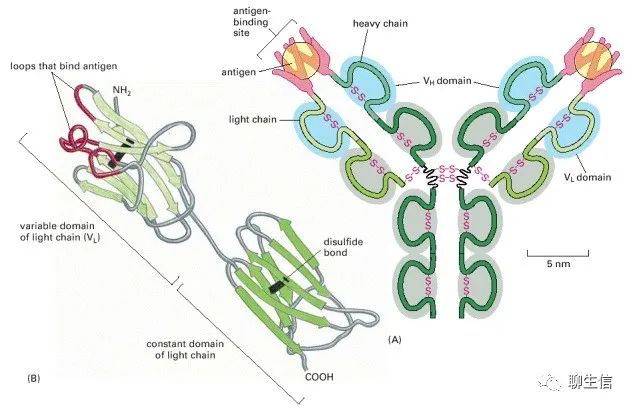
(A)由四个多肽链由二硫键连接在一起,含几个不同的免疫球蛋白结构域组成,用蓝色或灰色表示。抗原结合位点是在重链可变域(VH)和轻链可变域(VL)靠近的地方形成的。(B)轻链的带状模型显示了与抗原结合最密切的VL结构域部分,呈红色,贡献了(A)中每个抗原分子周围的指状环的一半。
这种环(loops)非常适合捕捉其他分子。它们允许大量的化学基团包围配体,这样蛋白质就可以用许多弱键与配体相连。由于这个原因,环常被用来形成蛋白质中的配体结合位点(loops are often used to form the ligand-binding sites in proteins)。
