Science | 从结构生物学的角度理解人类mRNA剪接体分支位点的识别
人类基因组上最初转录生成的是前体mRNA (pre-mRNA)。这些未成熟的mRNA需要经过一定的加工,如剪接 (去除内含子)、在5'端加一个7-甲基鸟苷酸“帽子”,及在3'端加上一个多聚腺苷酸尾,最后形成较短的有功能的成熟mRNA。
因此pre-mRNA剪接是真核生物基因表达的关键步骤。当剪接位点发生突变,或剪接错误地发生在其它符合剪接位点 (Splice site, SS)特征的碱基上,就会导致外显子缺失或内含子保留,进而引起基因表达异常,或蛋白质功能的改变。SS变异是许多疾病常见的致病变异。
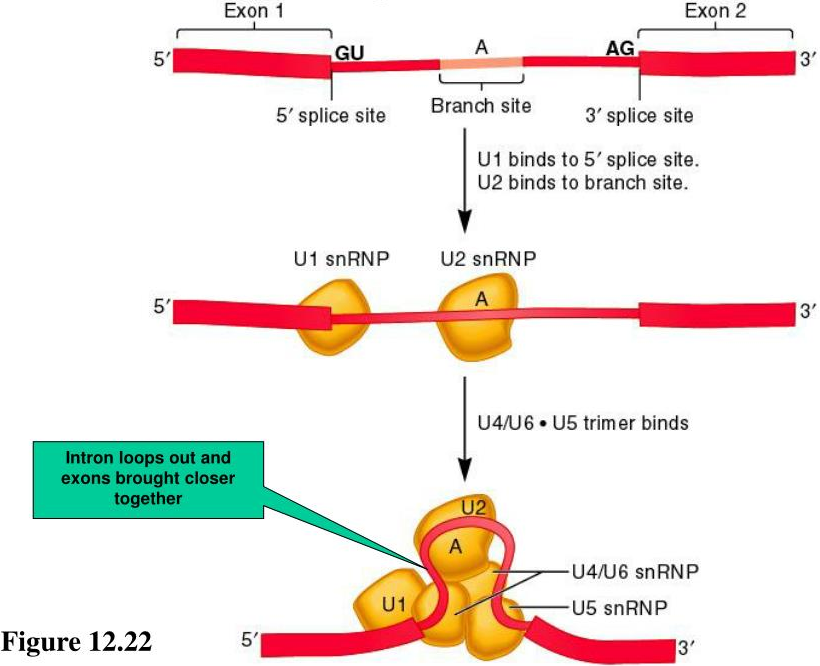
SS (GU, AG碱基), 分支位点 (Branch site, BS。A碱基), 红色箭头亲核反应(Nucleophilic attacks)
如何精准地从pre-mRNA中去除内含子?这个过程由一种被称为剪接体的大而动态的RNA-蛋白质复合物催化和控制,其中包含了5个小的”核”核糖核蛋白颗粒 (Small nuclear ribonucleoprotein particles, snRNPs。包含snRNA及其他组件蛋白)和几十个蛋白质因子,并从头组装在每个pre-mRNA底物上。在剪接体组装过程中,pre-mRNA中的三个保守位置,即5′-SS、BS和3′-SS,由剪接体的组件特异性识别,允许发生两步反式酯化反应。
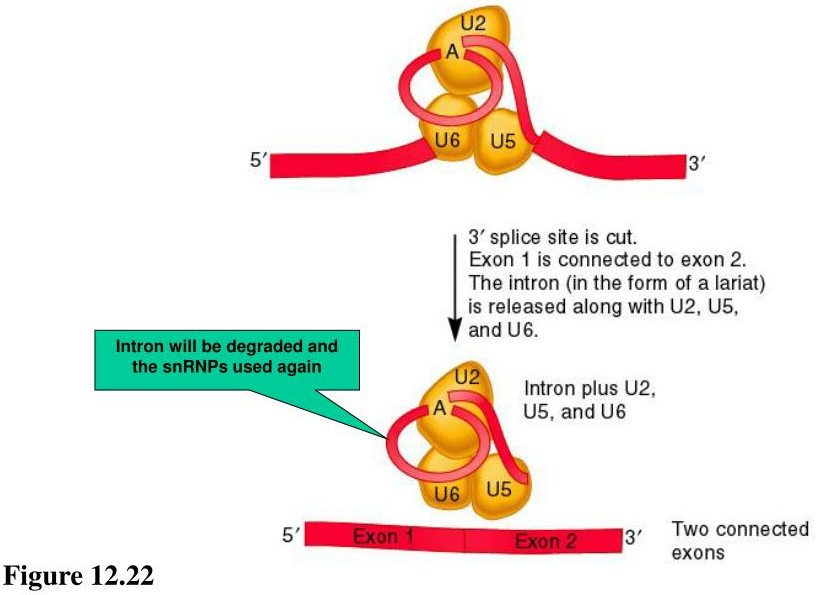
切除3’-SS, Exon 1和Exon2对接成功
因此,U2 snRNP识别内含子的BS序列是剪接体组装过程中的一个关键事件。
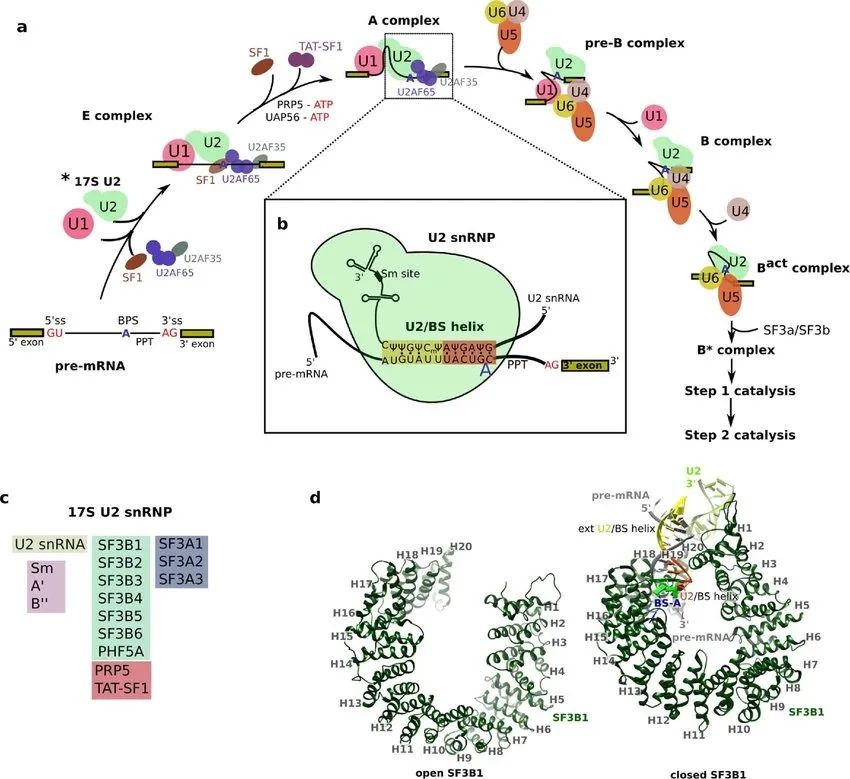
SF1, U2AF65,E complex, UAP65-ATP, A complex, U2/BS helix (图的中央)
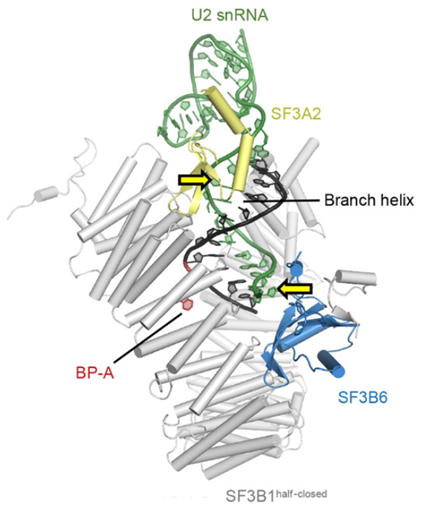
注意上图 (图c)中U2复合物中的SF3B6蛋白
在哺乳动物细胞中,BS最初由SF1(mBBP)与U2AF65等识别,同时U1与5′-SS结合,共同形成第一个剪接体组装中间体 (无ATP),即复合物E (E complex)。UAP65-ATP等参与复合物E后,SF1等组件脱离,形成复合物A(A complex),并在BS和U2之间形成碱基互补配对作用 (U2/BS helix, 上图中央)。
在后续剪接反应中,复合物内的多个组件精确地结合、重排和解聚,形成预组装复合物U4/U6.U5 Tri-snRNP及其它完全组装剪接体 (pre-B/B/Bact/B*/C/C*/P complex以及ILS复合物),如下图。
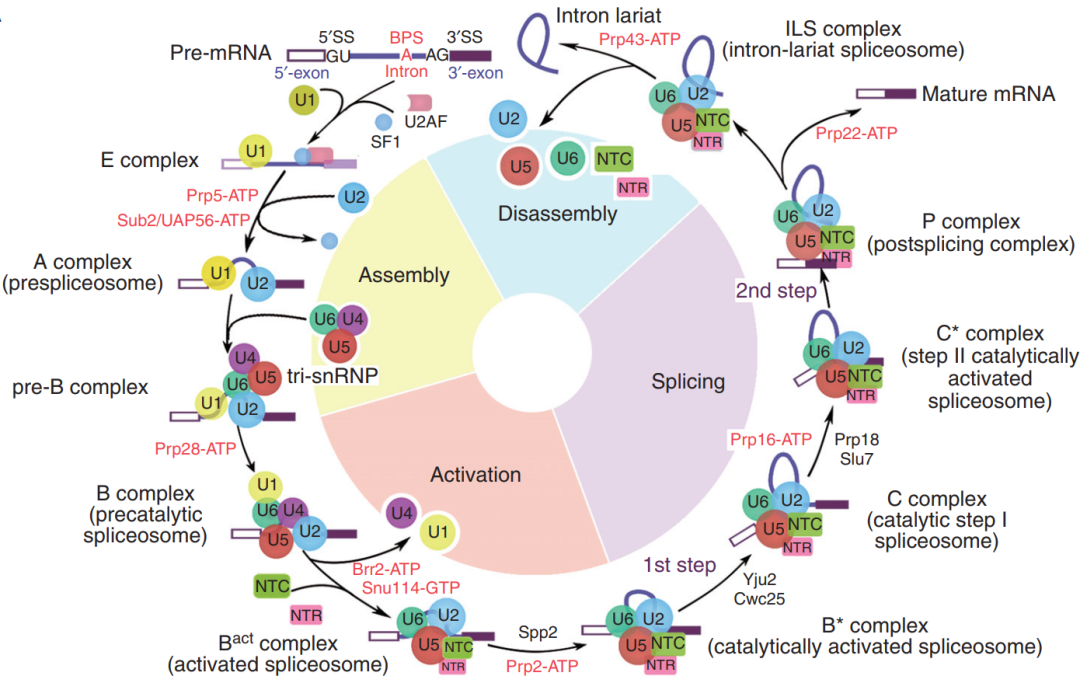
通过上面的介绍,我们知道U2识别内含子的BS序列是剪接体组装过程中的一个关键事件。但在哺乳动物中BS序列保守性差,仅通过碱基互补配对机制无法实现明确的内含子识别。为了解析出该事件发生时的剪切体形态结构,两周前 (11月25日)欧洲分子生物学实验室 (EMBL)和德国海德堡大学的研究人员在Science上发表了题为《Structural basis of branch site recognition by the human spliceosome》的研究型论文。研究人员分离了人类的17S U2 snRNP,并在体外重建其ATPD依赖性重塑和与前mRNA底物的结合。确定了一系列提供BS选择过程快照的高分辨率(2.0-2.2Å)结构。底物结合的U2 snRNP表明SF3B6稳定了BS:U2 snRNA双链结构,这有助于序列互补性差的内含子的结合。与底物结合不耦合的ATP依赖性重塑以与BS识别竞争的构象捕获U2 snRNA,提供基于分支螺旋稳定性的选择机制。
HTATSF1稳定17S U2 snRNP中的分支点相互作用的茎环 (Branchpoint-interacting stem loop, BSL)。作者对17S U2 snRNP的重建表明,HTATSF1RRM结合在由SF3B1的热重复序列H15和H16形成的疏水口袋中。相邻的H16和H17重复序列形成 HTATSF1LH的C端接口,包括残基239-251。
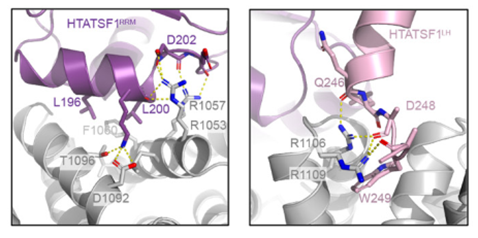
HTATSF1RRM结合在由SF3B1的热重复序列H15和H16形成的疏水口袋中
HTATSF1LH的C末端指向BSL,可能与已知的结合SF3B1ULM基序的HTATSF1UHM结构域相类似。HTATSF1的两个结构域与SF3B1形成稳定的界面,并从两侧夹持U2 snRNA BSL,表明该瞬时RNA二级结构具有直接的稳定机制。
HTATSF1的两个结构域与SF3B1形成稳定的界面,并从两侧夹持U2 snRNA BSL
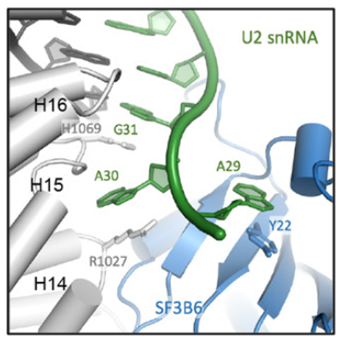
SF3B6稳定A-like U2 snRNP(BS:U2 snRNA)中的分支螺旋结构。17S和A-like U2 snRNP的比较表明,SF3B6和HTATSF1RRM与SF3B1HEAT的结合是互斥的,需要取代HTATSF1RRM才能稳定对接SF3B6。当BPS寡核苷酸与17S U2 snRNP结合时,在SF3B1的H14和H15附近出现额外的密度。虽然SF3B6是SF3B复合物的稳定成分,但在以前报道的SF3B复合物或U2snRNP的任何结构中都没有观察到SF3B6。SF3B6与位于分支螺旋5’端的U2 snRNA结合,因此它定义了凸起的BP-A相对于分支螺旋末端的确切位置。
U2 snRNA的腺嘌呤A29与SF3B6的Y22残基堆积在一起,放置在同一个口袋中。
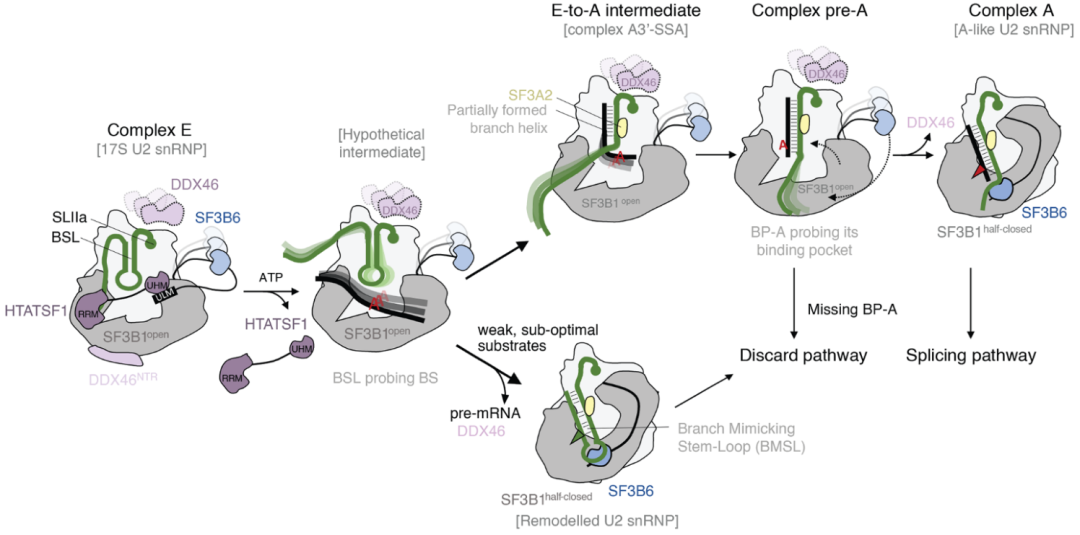
HTATSF1的解离在分支螺旋的形成和BMSL之间产生竞争。对弱的、次优底物的排斥形成了remodeled U2 snRNP,它的靶向是一个废弃的途径。稳定的底物逐渐形成分支螺旋。在没有正确定位、凸出的BP-A的情况下,复合体被靶向一条废弃的途径。分支螺旋的生产导致复合物A的形成,其中U2snRNP在结构上类似于A-like U2snRNP。
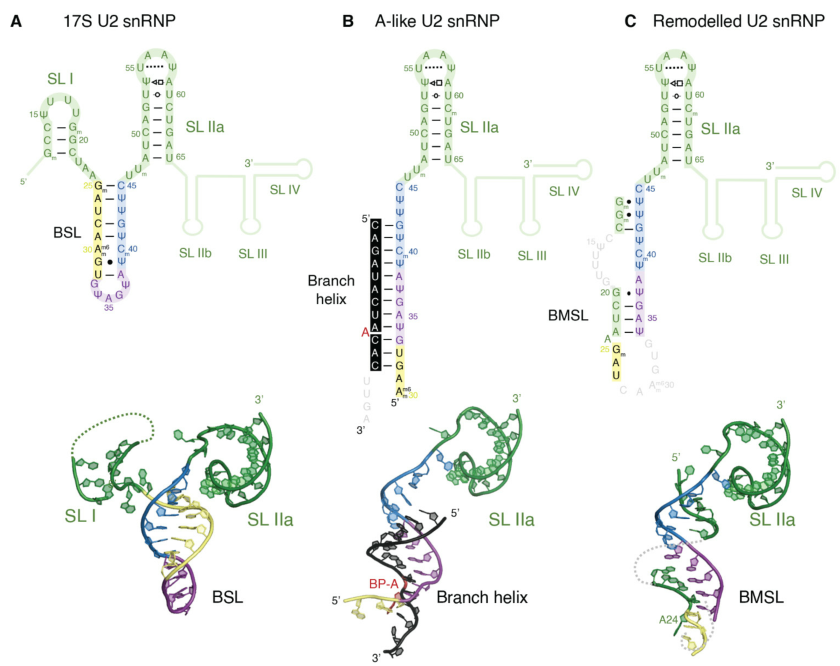
(A)17S、(B)A-like 和(C)remodeled U2 snRNP中U2snRNA的二级和三级结构。
总结,U2识别内含子的BS序列是剪接体组装过程中的一个关键事件,SF3B6在稳定分支螺旋方面发挥着以前未知的作用,这可能与U2 snRNA互补性较差的分支序列特别相关。本研究提供了U2 snRNP识别分支位点的复杂过程的几个高分辨率快照,有助于更好地理解人类Pre-mRNA的剪接机制。
往期精品(点击图片直达文字对应教程)
后台回复“生信宝典福利第一波”或点击阅读原文获取教程合集